ERRORES COMUNES EN LA RECOLECCIÓN Y MANIPULACIÓN DE MUESTRAS
PACIENTE SIN AYUNO
El aumento de triglicéridos que causa lipemia puede ser el resultado de un mecanismo patológico subyacente. Sin embargo, la lipemia se ve más comúnmente como un cambio posprandial en pacientes que no ayunan.
La lipemia aumenta la turbidez del suero y / o plasma, lo que ocasiona alteraciones en los análisis hematológicos y bioquímicos que dependen de la dispersión de la luz (p. Ej., Proteína total por refractometría, hemoglobina e índices relacionados, bilirrubina). 1
La forma más sencilla de evitar errores relacionados con la lipemia es exigir a los dueños de mascotas que ayunen al paciente de 8 a 12 horas antes del examen y la extracción de sangre planificada.
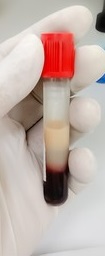

HEMÓLISIS IN VITRO
La hemólisis in vitro puede estar asociada con la recolección de muestras traumática, manejo inadecuado de la muestra, temperaturas extremas y / o procesamiento retrasado.
La espectrofotometría de absorbancia se usa para medir la concentración de muchos analitos bioquímicos y mide la cantidad de luz que pasa a través de una solución que contiene el analito (es decir, producto de una reacción enzimática). ) de interés.
La hemoglobina libre absorbe la luz, por lo que la presencia de hemoglobina libre puede interferir con la prueba y dar lugar a resultados inexactos. Además, la hemólisis in vitro marcada puede resultar en la liberación de iones y moléculas que se encuentran en concentraciones más altas en los fluidos intracelulares.
La hemólisis in vitro se puede prevenir mediante el uso de venopunción atraumática con sujeción y manipulación adecuadas del paciente, recolección adecuada de muestras (p. Ej., Aguja de gran calibre) y manipulación adecuada de muestras (p. Ej., Mezcla suave con anticoagulante y análisis rápido).
La refrigeración de la muestra es necesaria cuando el análisis de la muestra se retrasa, pero las muestras no deben colocarse directamente sobre hielo para disminuir la hemólisis.
MUESTRA COAGULADA
La extracción prolongada de sangre, la venopunción traumática y / o la mezcla inadecuada de sangre completa con un anticoagulante pueden dar como resultado una muestra coagulada.
Las muestras con coágulos no son apropiadas para el análisis de muestras.
Los coágulos microscópicos o los grumos de plaquetas asociados con la fervorosa agregación de plaquetas, especialmente en gatos, pueden producir una falsa trombocitopenia (es decir, pseudotrombocitopenia).
Todas las trombocitopenias notificadas deben verificarse mediante una revisión de frotis de sangre.

VOLUMEN DE MUESTRA INSUFICIENTE
La recolección de volúmenes de muestra diminutos o el uso de un tubo demasiado grande puede resultar en resultados desfavorables debido a la dilución por exceso de anticoagulante o un volumen de muestra insuficiente para ejecutar los ensayos solicitados.
Los tubos de extracción de sangre deben llenarse hasta el volumen de tubo especificado, que generalmente se indica mediante una línea de llenado sutil.
El anticoagulante EDTA es hipertónico en comparación con la sangre; sin embargo, la diferencia de tonicidad no da lugar a cambios clínicamente significativos en los resultados del hemograma completo si el tubo con EDTA se llena adecuadamente.
Cuando un tubo con EDTA no se llena adecuadamente, el exceso de volumen de anticoagulante con EDTA en relación con la sangre completa instiga el movimiento osmótico del agua intracelular a la solución de plasma / anticoagulante relativamente hipertónica en un intento de igualar la tonicidad, lo que resulta en la contracción de los eritrocitos (crenación) y disminución falsa del volumen de células empaquetadas del hematocrito hilado.
El volumen apropiado es especialmente importante para las pruebas de coagulación.
CONCLUSIÓN
Reconocer estos errores de recolección y muestreo puede ayudar a prevenir resultados erróneos y ayudar a interpretar los resultados cuando estas situaciones no se pueden evitar.
Al enviar una muestra a un laboratorio de referencia, los médicos deben comunicar los errores conocidos de recolección y manipulación para ayudar a garantizar una interpretación precisa por parte del patólogo clínico.
REFERENCIA
- Stockham SL, Scott MA. Conceptos introductorios. En: Stockham SL, Scott MA. Fundamentos de Patología Clínica Veterinaria. 2ª ed. Blackwell Publishing; 2008: 3-51.
- Hooijberg E, Leidinger E, Freeman K. Un sistema de gestión de errores en un laboratorio clínico veterinario. J Vet Diagn Invest. 2012; 24 (3): 458-468.
- Weiser G. Recolección de muestras, procesamiento y análisis de opciones de servicios de laboratorio. En: Thrall MA, Weiser G, Allison R, Campbell T, eds. Hematología Veterinaria y Química Clínica. 2ª ed. John Wiley & Sons; 2012: 34-39.
- Stockham SL, Scott MA. Eritrocitos. En: Stockham SL, Scott MA. Fundamentos de Patología Clínica Veterinaria. 2ª ed. Blackwell Publishing; 2008: 107-221.
- Weiser G. Tecnología de laboratorio para medicina veterinaria. En: Thrall MA, Weiser G, Allison R, Campbell T, eds. Hematología Veterinaria y Química Clínica. 2ª ed. John Wiley & Sons; 2012: 3-33.
- Norman EJ, Barron RC, Nash AS, Clampitt RB. Prevalencia de recuentos de plaquetas automatizados bajos en gatos: comparación con la prevalencia de trombocitopenia basada en la evaluación de frotis de sangre. Vet Clin Pathol. 2001; 30 (3): 137-140.
- Riond B, Waßmuth AK, Hartnack S, Hofmann-Lehmann R, Lutz H. Prevención eficaz de la pseudotrombocitopenia en muestras de sangre felina con el análogo de prostaglandina I2 Iloprost. BMC Vet Res. 2015; 11: 183.
- Stockham SL, Scott MA. Hemostasia. En: Stockham SL, Scott MA. Fundamentos de Patología Clínica Veterinaria. 2ª ed. Blackwell Publishing; 2008: 261-321.
- Furlanello T, Tasca S, Caldin, M y col. Cambios artificiales en la sangre canina después del almacenamiento, detectados con el analizador de hematología ADVIA 120. Vet Clin Pathol. 2006; 35 (1): 42-46.
- Bourgès-Abella NH, Geffré A, Deshuillers PL, Braun JP, Trumel C. Cambios en las mediciones hematológicas en sangre de perro sano y enfermo almacenada a temperatura ambiente durante 24 y 48 horas utilizando el analizador XT-2000iV. Vet Clin Pathol. 2014; 43 (1): 24-35.
- Bau-Gaudreault L, Grimes CN. Efecto del tiempo y el almacenamiento sobre el cambio tóxico o pseudotóxico en los neutrófilos caninos. Vet Clin Pathol. 2019; 48 (3): 400-405.
- Harvey J. Evaluación de eritrocitos. En: Harvey J. Veterinary Hematology: A Diagnostic Guide and Colour Atlas. Elsevier Saunders; 2012: 88.
AUTORES:
Linn Clarizio: DVMUniversidad Estatal de Kansas
Lisa M. Pohlman: DVM, MS, DACVPUniversidad Estatal de Kansas
